W3Schools Home Page
É importante entender a diferença entre químico e físico mudanças. Algumas mudanças são óbvias, mas existem algumas ideias básicas que você precisa conhecer. Mudanças físicas geralmente se referem a estados físicos da matéria. Mudanças químicas ocorrem em um molecular nível quando você tem duas ou mais moléculas interagindo. As mudanças químicas ocorrem quando as ligações atômicas são quebradas ou criadas durante as reações químicas.
Quando você pisa em uma lata e a esmaga, você forçou uma mudança física. No entanto, você apenas alterou a forma da lata. Não foi uma mudança no estado da matéria porque a energia na lata não mudou. Além disso, como essa foi uma mudança física, as moléculas na lata ainda são as mesmas moléculas. Nenhuma ligação química foi criada ou quebrada.
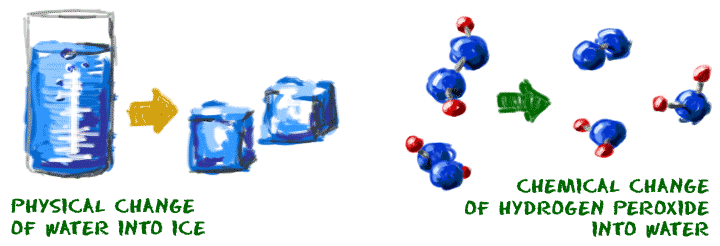
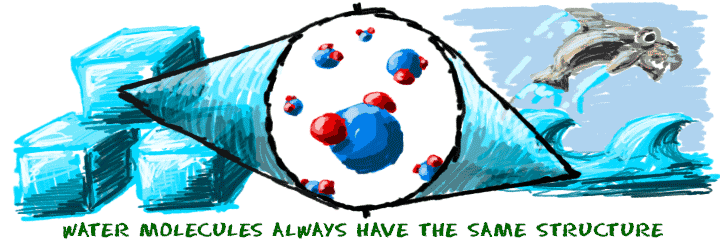
Quando você derrete um cubo de gelo (HdoisO), você tem uma mudança física porque você adiciona Energia. Você adicionou energia suficiente para criar uma mudança de fase de sólido para líquido. Ações físicas, como mudança de temperatura ou pressão, podem causar mudanças físicas. Nenhuma mudança química ocorreu quando você derreteu o gelo. As moléculas de água ainda são moléculas de água.
As mudanças químicas ocorrem em uma escala muito menor. Enquanto alguns experimentos mostram mudanças químicas óbvias, como uma mudança de cor, a maioria das mudanças químicas não são visíveis. A mudança química como peróxido de hidrogênio (HdoisOUdois) se transforma em água, você não pode vê-lo, pois ambos os líquidos são transparentes. No entanto, nos bastidores, bilhões de ligações químicas são criadas e destruídas. Neste exemplo, você pode ver bolhas de oxigênio (Odois) Gasolina. Essas bolhas são evidências de mudanças químicas.
Derretendo um cubo de açúcar é uma mudança física porque a substância ainda é açúcar. Queimar um cubo de açúcar é uma mudança química. O fogo ativa uma reação química entre o açúcar e o oxigênio. O oxigênio do ar reage com o açúcar e as ligações químicas são quebradas.
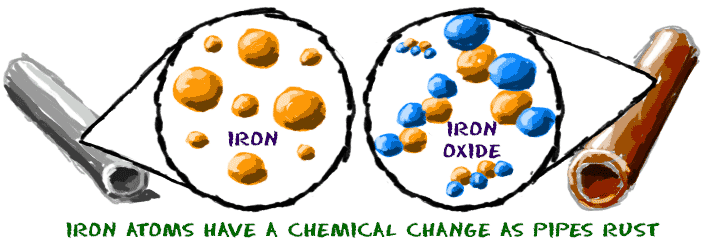
Ferro (Fe) ele oxida quando exposto ao gás oxigênio no ar. Você pode ver como o processo acontece durante um longo período de tempo. As moléculas mudam de estrutura à medida que o ferro é oxidadoeventualmente se transformando em óxido de ferro (FedoisOU3). Canos enferrujados em prédios abandonados são exemplos reais do processo de ferrugem.
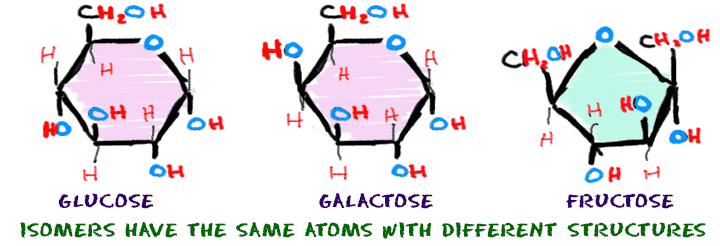
Algumas mudanças químicas são extremamente pequenas e ocorrem em uma série de etapas. Os compostos resultantes podem ter o mesmo número de átomos, mas terão uma estrutura diferente ou combinação de átomos.
Os açúcares glicose, galactose e frutose têm seis átomos de carbono, doze átomos de hidrogênio e seis átomos de oxigênio (C6H12OU6). Embora sejam feitos dos mesmos átomos, eles têm formas muito diferentes e são chamados de isômeros. Os isômeros têm átomos ligados em ordens diferentes.
Cada um dos açúcares passa por diferentes reações químicas devido a diferenças em sua estrutura molecular. Os cientistas dizem que o arranjo dos átomos permite um alto grau de especificidade, especialmente nas moléculas dos seres vivos. Especificidade significa que as moléculas só funcionarão em reações específicas, não em todas. Por exemplo, seu corpo usa glicose como fonte de energia. Se você comer moléculas de galactose, elas devem ser convertidas em glicose antes que seu corpo possa usá-las.
Receitas para químicos (NASA/NASA Connect Video)




