Evaporação


Às vezes, um líquido pode estar parado em um lugar (talvez uma poça) e suas moléculas se transformarão em gás. Esse é o processo chamado evaporação. Pode ocorrer quando os líquidos estão frios ou quando estão quentes. Ocorre mais frequentemente com líquidos mais quentes. Você provavelmente se lembra que quando a matéria tem uma temperatura mais alta, as moléculas têm uma temperatura mais alta. Energia. Quando a energia em moléculas específicas atinge um certo nível, elas podem ter um mudança de fase. A evaporação tem a ver com a energia em moléculas individuais, não com a energia média de um sistema. A energia média pode ser baixa e a evaporação ainda continua.
Você pode estar se perguntando como isso pode acontecer quando a temperatura está baixa. Acontece que todos os líquidos podem evaporar à temperatura ambiente e à pressão normal do ar. A evaporação ocorre quando átomos ou moléculas escapam do líquido e se tornam um vapor. Nem todas as moléculas em um líquido têm a mesma energia. Quando você tem uma poça de água (HdoisOU) Em um dia ventoso, o vento pode causar uma maior taxa de evaporação mesmo quando está frio lá fora.
A energia que você pode medir com um termômetro é realmente a energia média de todas as moléculas do sistema. Há sempre algumas moléculas de alta energia e algumas de baixa energia. Há uma variedade, porque as moléculas em um líquido podem se mover. Moléculas podem colidir umas com as outras, e quando colidem… Blam! Alguma energia se move de uma molécula para outra. Como essa energia é transferido, uma molécula terá um pouco mais e a outra terá um pouco menos. Com trilhões de moléculas saltando, às vezes moléculas individuais obtêm energia suficiente para se libertar. Eles acumulam energia suficiente para se transformar em gás quando atingem um nível de energia específico. Em uma palavra, quando a molécula sai, ela evaporou.
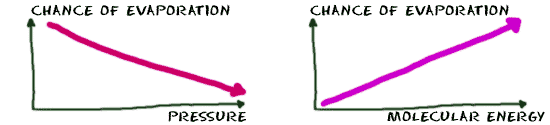
A taxa de evaporação também pode aumentar com a diminuição da pressão do gás em torno de um líquido. As moléculas gostam de se mover de áreas de maior pressão para áreas de menor pressão. As moléculas são basicamente sugadas para a área circundante para equalizar a pressão. uma vez o pressão de vapor do sistema atingir um nível específico, a taxa de evaporação diminuirá.
O Índice de Estresse Evaporativo (Vídeo NASA/GSFC)